Мой блог на сайте
Еще статьи по теме
- Продам стельных коров
- Тест молочное дело
- продаю сосуд Дьюара (30 литров)
- ООО Дары Кубани продает решетки животноводческие чугунные КРС 1000*500 б/у
- Опрос для тех, кто работает с молочным стадом
- Как узнать вес теленка?
- Дистанционный курс повышения квалификации
- Чугунные и пластиковые автопоилки для лошадей и КРС.
- кормушка угловая прямоугольная с накладкой 32592 Kerbl
- Кормушка навесная пластиковая секционная с решеткой для коз и овец Kerbl 323492
Академия ветеринарных наук
Поволжское региональное отделение
Кафедра микробиологии, вирусологии, эпизоотологии,
ветеринарно-санитарной экспертизы
Ульяновской государственной сельскохозяйственной академии
Н.А. Власов, Д.А. Васильев, А.И.Козин
Антибиотики и химиопрепараты
для борьбы с инфекционными
болезнями животных
Новые методы в профилактике и
лечении инфекционных болезней
Выдержки из учебного пособия
Дезинфекция с использованием теотропина
История
На начальном этапе изучения этого вещества ученые, проводившие его, не предполагали, что теотропин будет использоваться в биологии. Теотропин и его аналоги использовались для решения теоретических вопросов химии азотсодержащих соединений. Затем, когда их свойства были достаточно полно изучены и было налажено их промышленное изготовление, эти вещества стали использовать в различных областях промышленности: как компоненты ракетного топлива, добавки к горюче-смазочным веществам, в изготовлении полимерных материалов: исскуственного каучука, в составе порообразующей смеси для резинотехнических изделий, в составах усилитилей для черно-белой серебряной фотографии, для очистки газовых смесей от сероводорода и окиси серы и т.д.
Биологи заинтересовались этими веществами потому, что по структуре они близки к производным адамантана и, следовательно, можно было ожидать от них противовирусной активности, на предмет которой они и были испытаны в восьмидесятых годах. В результате этих испытаний на первом их этапе были получены весьма обнадеживающие результаты. Теотропин оказался малотоксичным для организма млекопитающих и птиц, имел сильную вирулицидную и бактерицидную активность при сравнительно низких концентрациях. Однако при его испытаниях как лечебно-профилактического препарата было установлено, что теотропин эффективно убивая внеклеточные вирусы, не действует на их репродукцию в зараженной клетке. Только после получения этих результатов он был с превосходными результатами совместно испытан ВНИИВВиМ и Московским институтом тонкой химической технологии в качестве инактиватора для получения биопрепаратов (вакцины, сыворотки и диагностикумы), а также в качестве дезинфектанта.
Свойства теотропина.
Теотропин – стабильное при хранении и нагревании вещество (плавится без разложения при температуре 194-196°, стабилен при хранении в сухом виде и температуре не выше 40° в течение не менее, чем 10 лет – срок наблюдения). Он представляет собой порошок желтоватого цвета со слабым специфическим запахом или без запаха в зависимости от степени очистки. Хорошо растворим в воде (насыщенный раствор имеет концентрацию свыше 50%), спирте, ацетоне. рН 10%-ого водного раствора в пределах 9,3-9,5.
Теотропин обладает антикоррозионными свойствами – защищает металлы от ржавения. При применении не выделяет агрессивных газов, не портит и не обесцвечивает окрашенные поверхности, не повреждает лаки и полимерные материалы. В концентрациях до 5% нетоксичен для млекопитающих и птиц, не раздражает кожные покровы и слизистые оболочки, при аэрозольном применении не вызывает раздражения дыхательных путей.
Действие теотропина на вирусы и бактерии.
Как уже отмечено, теотропин в низких концентрациях необратимо инактивирует практически все вирусы животных. Механизм инактивации основан на разрушении нуклеиновых кислот (РНК и ДНК). По устойчивости к теотропину вирусы (испытывали: ортомиксовирусы – вирусы гриппа человека, птиц и свиней, парамиксовирусы – НьюКасла, Юкейпа, чумы плотоядных, кори, пикорна – ящура, калицивирусы – везикулярной экзантемы свиней, герпеса – герпес человека типов 1,2, инфекционного ларинготрахеита птиц, болезни Ауески, иридовирусы – вирус африканской чумы свиней и много других) различаются слабо: растворы с концентрацией дествующего вещества 0,1-0,3% при температурах 10-20° инактивируют вирусы за 3-24 часа. Растворы с концентрацией 0,5-1,0% инактивируют их за 0,25-3 часа. Раствор с концентрацией 2,5% за сутки полностью инактивирует споровую форму возбудителя сибирской язвы. Так же эффективно препарат действует на микоплазмы, риккетсии, хламидии и простейших.
При определении эффективности стерилизации теотропином поверхностей из различных материалов с использованием свежеприготовленных и хранившихся до использования в течение 15-120 суток растворов показало следующее. Для полной инактивации неспорообразующих микроорганизмов на пористых поверхностях (кирпич силикатный, красный, цемент) необходимо применение 3% растворов (экспозиция 18 часов, расход 1 л/м2), на гладких поверхностях (метлахская плитка, металл, дерево, кафель, крашенный бетон, дерево и штукатурка, стекло) – 1-2% растворы (экспозиция 18 часов, расход 1 л/м2). Дезинфекция тканей и нетканных волокнистых материалов достигается их замачиванием в 2,5% растворе на ночь.
При дезинфекции тары, поверхности пищевых яиц используются 0,5% растворы теотропина при комнатной температуре и экспозиции в течение 1 часа.
При проведении аэрозольной дезинфекции производственных помещений, которую можно проводить как в отсутствие животных, так и в их присутствии, следует исходить из следующего. Концентрация раствора для обработки 1%, расход 0,004-0,040 л/м3, экспозиция без вентиляции 8-12 часов. После проведения дезинфекции обмывка для удаления остатков дезинфектанта не производится. Максимально допустимой концентрации этого вещества в воздухе животноводческих помещений, т.е. его концентрации, которая токсична для животных, находящихся в дезинфицируемом помещении, установить не удалось, поскольку даже 25% раствор при расходе 0,040 л/м3 и экспозиции в течение 18 часов оказался безвредным для мышей, крыс, цыплят и поросят.
Специально проведенные испытания при дезинфекции родильного отделения свинофермы за 1,2 суток до опороса и 1,2 и 3 суток после начала первых опоросов аэрозольным методом и даже обмывкой раствором дезинфектанта свиноматок перед родами и поросят в возрасте до двух суток показали безвредность такой обработки.
Аналогичные результаты показала и дезинфекция выводного шкафа (специальной камеры для обработки яйца перед выводом) с цыплятами в течение первых суток с начала выведения цыплят, причем при такой обработке можно использовать сложные составы, включающие мидантан, пефлоксацин (или другие антибиотики) и теотропин. Разработана и технология для этой цели, включающая этапов. Первый – обработка яйца замачиванием в растворе теотропина перед закладкой на инкубацию. Второй – аэрозольная обработка теотропином яйца за двое суток перед выводом. Третий – аэрозольная обработка выведшихся цыплят в выводной камере составом, включающим теотропин, пефлоксацин и, при наличии показаний, мидантан. Четвертый – дезинфекция помещения, например, броллерного цеха, обычными дезинфектантами перед посадкой. Пятый – аэрозольная дезинфекция помещения броллерного цеха с цыплятами на седьмые и девятые сутки после посадки. Шестой – введение в питьевую воду пефлоксацина и, при наличии показаний – мидантана, на промежуток с седтмых по четырнадцатые сутки. Испытания в производственных условиях этой технологии профилактической обработки броллерных цыплят показали значительное уменьшение заболеваемости в раннем возрасте, улучшение кормоотдачи, возрастание массы тела.
Токсичность теотропина и меры безопасности при проведении дезинфекции.
Теотропин относится к малотоксичным веществам. Острая токсическая доза (вызывает отравления при однократном применении) при парентеральном введении составляет 375 мг/кг живой массы (примерно 0,6 литра 5%-ого раствора для взрослого человека, 1,8 л для взрослой свиньи, 3,0 л для коровы). Хроническая токсичность – 165 мг/кг живой массы. Химиотерапевтический индекс при парентеральном применении с целью лечения бактериальных болезней (отношениее минимальной терапевтической дозы к токсичной) составляет 300. Как уже отмечено выше, теотропин не раздражает кожи и слизистых оболочек глаз, дыхательных путей, мочеполовой системы. Для приготовления концентрированных растворов и работы с ними следует использовать резиновые перчатки, для работы с разбавленными растворами (менее 5%) специальных мер предосторожности не требуется, кроме предотвращения приема внутрь больших количеств раствора. При попадании в глаза их следует промыть водой и раствором борной кислоты, поскольку растворы теотропина обладают слабощелочным рН.
При проведении аэрозольной дезинфекции не рекомендуется длительное нахождение в обрабатываемом помещении людей, особенно склонных к алергическим реакциям и больных бронхиальной астмой. При нахождении в помещениях, содержащих аэрозоль, рекомендуется использование ватно-марлевых повязок для защиты органов дыхания и герметизирующих очков для защиты глаз.
Опыт применения дезинфекции с помощью теотропина показал, что он очень удачно дополняет комплексную обработку животных антибактериальными и противовирусными препаратами в промышленном производстве продуктов животноводства.
Пример № 1.
Профилактическая противобактериальная обработка цыплят.
Цель и общая характеристика обработки.
Данный пример показывает эффект применения препарата Абактан и дезинфекции теотропином в условиях броллерного производства. Обработка проводилась с целью нормализации микробного пейзаже помещения. Прогнозируемыми результатами были: элиминация условно-патогенных бактерий из цеха в целом, на основе этого – увеличение сохранности.
Характеристика и анализ ситуации.
Анализ динамики падежа цыплят за 90 суток после вылупления был проведен на основании зоотехнической отчетности по птице ремонтного стада. На основании его данных, интерпретированных по отношению к условиям бролллерных цехов, стало очевидным, что максимум падежа циплят приходится на первые 20 дней жизни.
Для проведения производственного эксперимента были взяты 7 залов с общим поголовьем около 150 000. Три зала обрабатывали по описанной ниже методике (опытные), а четыре других – с использованием стандартных ветеринарных процедур. Поголовье при посадке составляло в опытных залах 21 500, 11 000, 30 600 (всего 63 100) голов, в контрольных – 11 000, 12 100, 31 400, 32 000 (всего 86 500) голов.
В динамике отхода птицы имелся один слабо выраженный пик на 4-8 сутки после посадки. Основным достаточно распространенным симптомом являлась диарея, возникавшая после рассасывания яичного желтка (8-9 сутки) менее чем у 20% цыплят, однако, судя по динамике отхода птицы, она не была основной причиной отхода. Неудовлетворительность ситуации заключалась еще и в недостаточно интенсивном росте птицы, основной причиной которого являлось не вполне качественное кормление.
Результаты изучения микробного пейзажа цеха показали следующее.
Диагностические исследования на эпизоотически значимые вирусные и бактериальные болезни (парамиксовирусы 1-го и 2-го типа, грипп, ИЛТ и др.) показали их отсутствие.
Определение антибиотикоустойчивости микрофлоры (пробы воздуха, смывы со стен и пола) показало, что любой из числа стандартных антибиотиков снижает количество бактериальных колоний на агаре минимум в 4 раза.
На основе полученных данных был сделан вывод о том, что эпизоотическая ситуация в цехах характеризуется как благополучная, отход птицы, находящийся в пределах нормативов, обусловлен условно-патогенными микроорганизмами на фоне ее ослабления не вполне удовлетворительным рационом. Отход птицы составлял 6%, однако, продуктивность не обеспечивала необходимой массы птицы к концу периода откорма.
Методика обработки.
При формировании экспериментального цеха поверхность яиц при закладке в инкубаторы была обработана 0,5% раствором теотропина. Выводную камеру за сутки перед вылуплением обрабатывали аэрозольно 1% раствором теотропина при расходе раствора 0.040 л/м3 и экспозиции 10-12 часов. После вылупления цыплят в выводной камере обрабатывали Абактаном аэрозольно (концентрация раствора 4%, расход 0,025 л/м3, экспозиция 10-12 часов).
Зал перед посадкой цыплят обрабатывали раствором теотропина аэрозольно (1%, 0.03 л/м3, в течение ночи). Абактан цыплятам давали с питьевой водой в дозе 10 мг/кг живого веса 1 раз в сутки в течение 5 суток, начиная с первых суток после формирования зала.
Результаты.
Из данных, полученных в ходе опыта, видно следующее. В контрольных залах общей численностью 86 500 голов за период с первого по 21 день после посадки пало 4 762 головы, что составляет 5,50% от исходной численности при посадке. За это же время в опытных залах численностью 63 100 голов пало 2 165 голов, или 3,43%. Отмечено, что внешний вид и состояние цыплят в опытной группе были заметно лучше, а средний вес на 21 сутки в опытных залах был на 40 г выше, чем в контрольных.
Таким образом, обработка цыплят позволила в расчете на 100 000 голов дополнительно сохранить в период с первого по двадцать первый день после посадки 2 070 броллеров, причем средний живой вес цыплят в опытной группе был на 40 г больше, чем в контрольной. Это эквивалентно получению дополнительно 4,6 тонны живого веса цыплят в возрасте двадцати одного дня.
Пример № 2.
Лечебная комплексная антивирусная и противобактериальная обработка подсосного молодняка свиней.
Цель и общая характеристика обработки.
Данный пример показывает эффект применения комплексной обработки молодняка свиней в очаге вспышки трансмиссивного гастоентерита (ТГС). Обработка с изменением микробиологического пейзажа: проводилась иммунизация свиноматок против трансмиссивного гастроентерита, дезинфекция помещениий, в которых проводились туровые опоросы, обработки новорожденных поросят Абактаном. Нормализации микрофлоры желудочно-кишечного тракта пробиотиками не проводили.
Прогнозируемыми результатами были: элиминация условно-патогенной микрофлоры, подавление репродукции вирулентного вируса ТГС свиней из организма свиноматок, индукция колостральных вируснейтрализующих антител с целью защиты ими новорожденных поросят от заражения вирусом ТГС, предупреждение поражений условно-патогенной микрофлорой новорожденных поросят и, на этой основе повышение сохранности поросят.
Характеристика и анализ ситуации.
Анализ динамики падежа и вынужденного убоя подсосных поросят был проведен на основании данных зоотехнического учета за 18 месяцев по шести отдельным цехам, где производились опоросы.
В каждом из цехов после окончания формирования содержались в среднем по 150 свиноматок. На протяжении трех последних перед началом обработки туров опоросов средний выход поросят по цеху составлял 50 голов, т.е. в среднем 1/3 поросенка на свиноматку. Динамика отхода была характерна для ТГС: заболевание и начало отхода – на 3-5 сутки после опороса, затем их массовая гибель в промежутке от 6 до 15 суток, затем постепенная гибель еще примерно 50% оставшихся в живых к 15-ым суткам поросят. Оставшиеся поросята были ослабленными, имели низкую упитанность и неудовлетворительный внешний вид. После отъема животные росли плохо. Постановка предварительного диагноза на ТГС была затруднена, поскольку свиноматки регулярно прививались против ТГС инактивированной вакциной.
Результаты изучения микробного пейзажа цехов опороса доращивания показали следующее.
Диагностические исследования на эпизоотически значимые вирусные и бактериальные болезни (КЧС, грипп, ТГС, болезнь Ауески, парвовироз, реовирусный энтерит, сальмонеллез, пастереллез, отечная болезнь) показали наличие высоковирулентного вируса трансмиссивного гастроентерита свиней (подтверждено вирусовыделением в культуре клеток и биопробой) и низковирулентного вируса гриппа (подверждено иммуноферментным анализом и вирусовыделением в культуре куриных эмбрионов), патогенных штаммов сальмонелл (подверждено бактериологическим анализом и биопробой) и токсигенного цитробактера (подтверждено бактериологическим анализом и пробой на токсин).
Определяли патогенность для интактных поросят и антибиотико-устойчивость бактериальной микрофлоры кишечника павших и больных поросят, а также вирулентность выделенных штаммов вируса ТГС и гриппа. Установлено следующее. Выделенный штамм вируса ТГС вызывает гибель более, чем 90% поросят от неиммунных свиноматок. Выделенный штамм вируса гриппа патогенен для развивающихся куриных эмбрионов и молодняка свиней. У свиней 45-50-дневного возраста он вызывает респираторное заболевание, сопровождающееся повышением температуры тела, ухудшением аппетита, синюшностью ушей у части поросят и, в отсутствии осложнений, вызванных секундарной микрофлорой, – выздоровлением через 7-14 суток. Выделенный штамм сальмонеллы был для поросят низковирулентным. В лабораторной биопробе вызывал у 25% зараженных поросят в возрасте 20-30 суток прогрессирующее истощение, дерматиты, нервных явлений не отмечено. Возбудитель из испытанных антибиотиков был чувствителен к стрептомицину и хлортетрациклину. Цитробактер при парентеральном введении не вызывал видимой патологии, был не чувствителен ко всем испытанным стандартным антибиотикам.
На основе полученных данных были сделан вывод. Первый пик падежа был вызван трансмиссивным гастоентеритом, осложненным бактериальными инфекциями и поражениями дыхательных путей вирусом гриппа. Последующие потери поголовья обусловлены бактериальными поражениями ослабленных после переболевания ТГС и гриппом поросят. Уровень потерь поголовья за отъемный период при стандартных ветеринарных обработках составлял 95,8%.
Методика обработки.
Обработке были подвергнуты 5 цехов по проведению опоросов. Свиноматок дважды вакцинировали живой вакциной против ТГС. Корпус со свиноматками дезинфецировали теотропином аэрозольным способом трижды – за 1-3 дня до опороса, на 1-3 сутки после начала опоросов и на 15-17 сутки (после обработки животных Абактаном). Обработку абактаном свиноматок и поросят проводили путем парентерального применения в дозе 5 мг/кг живого веса трехкратно раз в сутки на 13-15 сутки после опороса.
Результаты.
Из данных, полученных в ходе опыта, видно следующее. При стандартных ветеринарных обработках сохранность поросят за весь подсосный период составляла 4,2%. После описанной выше обработки сохранность поросят составила 94%, а выход поросят возрос до 9 на свиноматку. Анализ микробного пейзажа показал отсутствие в нем вирусов ТГС и гриппа, сальмонелл и токсигенного цитробактера.
При проведении следующих туров опоросов в этих цехах в схему обработки были внесены изменения с учетом коррекции микробного пейзажа. Были усилены санитарные меры на входе в корпуса (дезинфекция обуви и одежды персонала, предметов ухода), исключена обработка Абактаном свиноматок и поголовная обработка им поросят. Парентеральное введение абактана проводилось только ослабленным животным. Дезинфекция помещения проводилась однократно перед опоросом. Эти изменения не привели к уменьшению выхода поросят.
Таким образом, применение данного режима обработки позволила ликвидировать эпизоотический очаг, нормализовать микрофлору цехов в целом и на этой основе увеличить выход поросят более, чем в 20 раз.
УДК: 619: 616. 9
Учебное пособие по курсу эпизоотологии для студентов факультета ветеринарной медицины
Академия ветеринарных наук, кафедра микробиологии, вирусологии, эпизоотологии и ВСЭ Ульяновской государственной сельскохозяйственной академии
Авторы: Заведующий лабораторией ВНИИВВиМ, ст.н.с., к.б.н. Н.А. Власов, заведующий кафедрой УГСХА проф., д.б.н. Д.А. Васильев, руководитель курса эпизоотологии УГСХА, доцент, к.в.н. А.И. Козин.
Утверждено методической комиссией факультета ветеринарной медицины 1997 года.
Рецензент:
© Н.А. Власов, Д.А. Васильев, А.И.Козин.















































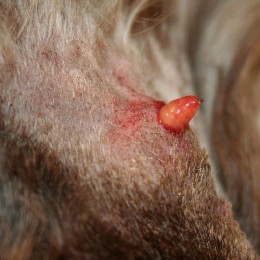

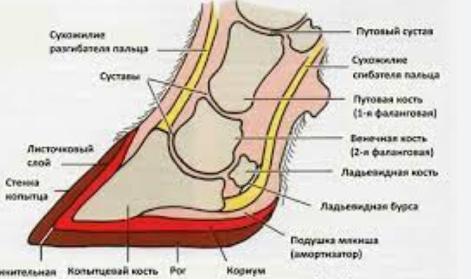 ЧТО ТАКОЕ КОПЫТНАЯ ГНИЛЬ?
ЧТО ТАКОЕ КОПЫТНАЯ ГНИЛЬ?  Применение теотропина в ветеринарии
Применение теотропина в ветеринарии  Дезинфицирующее средство Теотропин Р+
Дезинфицирующее средство Теотропин Р+ 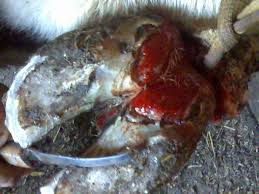 Копытная гниль – решение есть.
Копытная гниль – решение есть.  На ферме в Омской области от удара током погибли 35 телят
На ферме в Омской области от удара током погибли 35 телят